胶质母细胞瘤(GBM)是一种极具侵袭性的脑癌,其治疗难度大、死亡率高,成为医学领域的一大挑战。据估计,巴西每年新增GBM病例在10000至12000例之间。GBM约占所有脑瘤的49%,但其患者的生存期极短,诊断后通常仅能存活约12个月。因此,科学家们一直在寻找新的治疗策略,以提高患者的生存率和生活质量。
目前,GBM的常规治疗方式包括手术切除、放疗和化疗。主要使用的化疗药物是替莫唑胺(TMZ),但即便如此,该疾病仍极易复发,并且复发后的肿瘤通常更加具有侵袭性。针对这一挑战,巴西圣保罗大学生物医学科学研究所(ICB-USP)的一项新研究揭示了一种可能影响GBM进展的关键蛋白——朊病毒(Prion Protein, PrP) 。相关研究成果已发表在BMC Cancer 期刊上。

朊病毒在GBM中的关键作用
研究团队发现,朊病毒在GBM的生物学进程中发挥着重要作用。该蛋白在健康人体中广泛存在,主要影响中枢神经系统的功能,可调节大脑可塑性,并参与记忆形成和神经元交流。然而,研究人员在分析GBM患者样本时发现,侵袭性较强的肿瘤中朊病毒的表达水平显著升高 ,这引发了他们的兴趣,并促使他们深入探究该蛋白与GBM之间的关系。
肿瘤干细胞与复发机制
Lopes教授解释,GBM的治疗瓶颈在于肿瘤干细胞 (胶质母细胞瘤干细胞)的存在。手术和替莫唑胺疗法能够杀死快速增殖的肿瘤细胞,但部分肿瘤干细胞仍潜伏于脑组织中处于休眠状态。一旦这些细胞被重新激活,它们可以再次启动肿瘤生长,导致癌症复发。
她指出:“肿瘤干细胞具有强大的自我更新能力,它们可以在静止状态下隐藏一段时间,但一旦‘苏醒’,便能快速繁殖,重建肿瘤结构。”
基因编辑揭示朊病毒影响
为了深入了解朊病毒对GBM干细胞的影响,研究团队进行了体外实验。他们发现,当培养GBM干细胞时,朊病毒的水平显著上升,表明该蛋白在调节肿瘤干细胞方面发挥了重要作用。
随后,研究人员使用CRISPR-Cas9基因编辑技术 ,阻断了GBM干细胞中的朊病毒表达。实验结果显示:缺乏朊病毒的肿瘤干细胞,其增殖能力和侵袭能力均显著下降 。这表明,朊病毒可能是GBM治疗的潜在靶点。
Lopes教授表示:“虽然朊病毒可能不是GBM发展的唯一驱动因素,但它很可能在多个信号通路中起作用。因此,我们正在继续研究它的其他作用机制,以及它与其他关键分子的相互作用。”
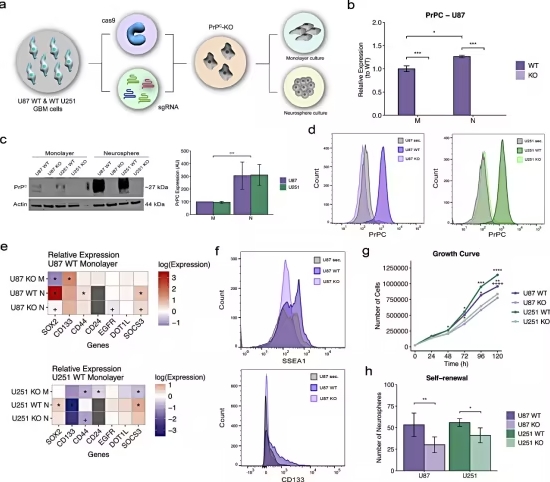
朊病毒与CD44的相互作用
在进一步研究中,团队发现朊病毒与CD44蛋白 存在相互作用。CD44是一种已知的癌症干细胞标志物,在乳腺癌和结肠癌等多种癌症的细胞浸润过程中发挥重要作用。
Lopes教授指出:“我们最近发现,朊病毒能够调控CD44的表达。目前,我们正在研究这两种蛋白如何相互作用。已有的实验结果表明,朊病毒可以作为一种支架,在细胞膜上创建多蛋白信号传导平台,使肿瘤细胞能够存活和增殖。当我们通过基因编辑技术阻断朊病毒后,发现其缺失会抑制肿瘤细胞的自我更新、迁移和浸润能力。”
临床应用展望
尽管该研究取得了令人鼓舞的进展,但目前尚无法预测这些发现何时能够应用于临床治疗。Lopes教授强调,这项研究属于基础研究,将其转化为实际治疗方案仍需要多年时间 。不过,该研究为未来GBM的新型靶向治疗策略提供了重要的科学依据。
她总结道:“我们正在逐步揭示朊病毒如何调节GBM肿瘤生物学,并研究它与其他关键分子的相互作用。这项研究有望为GBM患者带来新的治疗选择,提高生存率,并改善患者的生活质量。”