近日,空军军医大学西京医院 窦科峰院士团队在国际权威期刊 Nature 发表研究论文,公布了世界首例基因编辑猪肝脏移植人体 的突破性进展。研究团队成功将经过基因改造的猪肝移植到一名脑死亡患者 体内,并监测其运行情况,结果表明,该器官在人体内存活并正常工作长达10天 ,且未出现明显的免疫排斥反应。这一研究为未来异种器官移植 提供了重要的理论基础,或将成为肝衰竭患者等待人类供体肝脏的过渡疗法 。

基因编辑猪肝移植:手术关键步骤
在严格的医院伦理监督 下,研究团队选择了一名生命体征稳定的脑死亡患者,采用异位辅助肝移植方案 ,即在不切除原有肝脏的情况下,将基因改造的巴马小型猪 肝脏移植入人体。手术过程包括以下关键步骤:
血管连接 :将猪肝的肝动脉 与患者腹主动脉 对接,确保血流供应;
静脉回流 :猪肝的门静脉 连接至患者下腔静脉 ;
胆汁引流 :建立外部胆汁排放通道 ,监测胆汁分泌情况。
移植后10天:猪肝运行稳定,功能正常
移植后,研究团队持续监测肝功能、血流动力学及免疫反应 ,结果显示:
胆汁分泌 :移植2小时后,猪肝开始产生金黄色胆汁 ,10天内累计分泌66.5毫升 ;
蛋白合成 :猪血清白蛋白水平持续升高,提示肝脏合成功能正常 ;
血流稳定 :肝动脉血流速度稳定在41.45-60.63 cm/s ;
无严重排斥 :组织检查显示,移植肝脏再生良好 ,未出现典型的免疫排斥反应 。
这些结果表明,基因编辑猪肝能够在人体内正常运作 ,为异种器官移植的进一步临床应用奠定了基础。
突破免疫排斥难题:六基因改造技术
异种器官移植的最大挑战在于免疫排斥反应 。直接移植猪器官会导致超急性排斥 ,因为猪细胞表面的α-半乳糖抗原 会引发人体免疫系统的强烈攻击。为此,中国科研团队采用六基因编辑技术 ,改造供体猪(巴马小型猪):
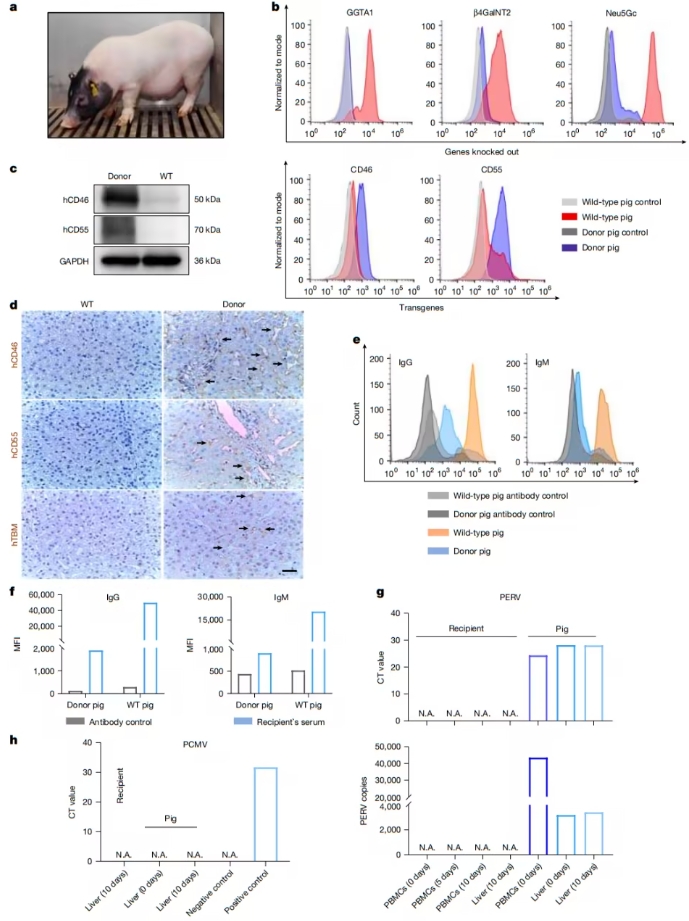
三大“排异因子”基因敲除 :
GTKO :去除α-半乳糖抗原,减少超急性排斥;
CMAH :抑制新抗原合成,降低免疫攻击;
B4GALNT2 :减少免疫识别,提高生存率。
三重“保护盾”基因植入 :
hCD46、hCD55 :调节补体系统,抑制免疫攻击;
hTBM :防止凝血失衡,提高肝脏存活率。
这些基因改造使得猪肝能够更好地适应人体环境 ,显著降低了排异反应。
免疫“攻防战”:精准抑制排异
为了进一步控制免疫排斥,研究团队制定了多靶点免疫抑制方案 :
术前 :使用抗胸腺细胞球蛋白 清除T细胞,并应用补体抑制剂 防止超急性排斥;
术后 :联合他克莫司、霉酚酸酯 (经典抗排异药)+ 利妥昔单抗 (抑制B细胞活化)。
监测结果显示:
T细胞活性被有效抑制 ;
B细胞在术后第3天短暂激活 ,但及时受到控制 ;
炎症因子(IL-6、TNF-α)维持低水平 ,补体沉积极少。
这一免疫调控策略,使猪肝在人体内实现了稳定存活 。
未来展望:猪肝或成肝衰竭患者的“生命桥梁”
全球每年有数百万肝病患者 因等待不到供体而失去生命。我国每年新增30万-50万肝衰竭患者 ,但真正能接受人类肝脏移植的人数极为有限。基因编辑猪肝移植 的成功,意味着未来可能为这些患者提供替代或过渡治疗 方案。
研究团队计划:
延长移植存活时间 ,观察长期效果;
探索原位移植方案 (彻底替换病变肝脏);
优化基因编辑技术 ,进一步降低排异风险。
生物医学新时代:定制化猪器官或将成为现实
近年来,异种移植技术飞速发展 ,从猪心脏、猪肾脏 到猪肝脏 ,基因编辑技术不断完善,使“定制化器官”成为可能。提供本次实验供体猪的成都中科奥格生物科技有限公司 ,正致力于打造未来器官工厂 ,研发用于人体移植的猪器官、生物医用材料 等。
潘登科研究员表示,中科奥格采用的六基因编辑技术 与美国Revivicor公司开发的十基因编辑猪 有所不同,但均在临床研究中表现出良好效果。值得一提的是,巴马小型猪的器官大小与人类更接近 ,无需进行额外的生长基因敲除,使其更适合移植应用。
总结:医学历史性突破,未来可期
这项全球首例基因编辑猪肝移植研究 表明:
基因改造猪肝能够在人体内正常存活 ,无明显排异;
凝血机制趋于正常 ,避免了异种移植中的常见风险;
提供急性肝衰竭的过渡治疗新方案 ,可能拯救大量等待供体的患者。
随着基因编辑、免疫调控和外科移植技术的进步 ,异种器官移植将加速向临床应用迈进。未来,定制化猪器官移植或将彻底改写医学历史 ,为无数患者带来新生希望。