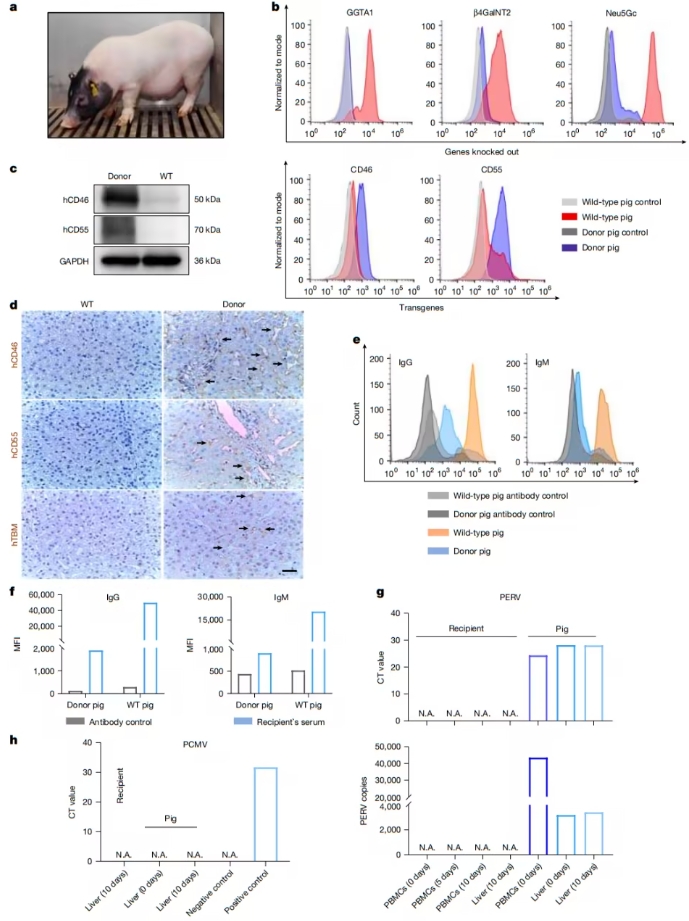
肝细胞癌(HCC)是全球癌症相关死亡的第三大原因,仅次于肺癌和胃癌。HCC通常与慢性乙型肝炎病毒感染相关,且一旦被诊断,患者大多数处于疾病的晚期,五年生存率低于50%。近年来,免疫治疗的兴起使得科学家们开始关注肿瘤微环境(TME)在癌症发展中的作用,尽管如此,HCC的免疫逃逸机制仍然复杂且尚未完全明了。
近日,国际期刊《Nature Communications》发布了一项新研究,题为“HBV相关肝细胞癌通过长非编码RNA HDAC2-AS2抑制抗肿瘤CD8+ T细胞”,该研究由中国科学院生物物理研究所的科学家们牵头,揭示了长非编码RNA(lncRNA)HDAC2-AS2在肝细胞癌免疫逃逸中的重要作用,为肝癌的治疗提供了新的理论基础。
肝细胞癌中的肿瘤微环境与免疫逃逸
肿瘤微环境是肿瘤细胞生存的“土壤”,包括免疫细胞、细胞外基质以及各种信号分子。在肝细胞癌中,肿瘤细胞通过复杂的机制抑制免疫系统的正常功能,从而逃避免疫监视。长非编码RNA(lncRNA)是一类不编码蛋白质的RNA分子,近年来被发现广泛参与肿瘤的发生、发展以及免疫逃逸的调控。尽管如此,lncRNA在肝细胞癌中的具体作用机制尚不清楚。因此,研究人员专门探讨了这些分子在免疫逃逸中的潜在作用。
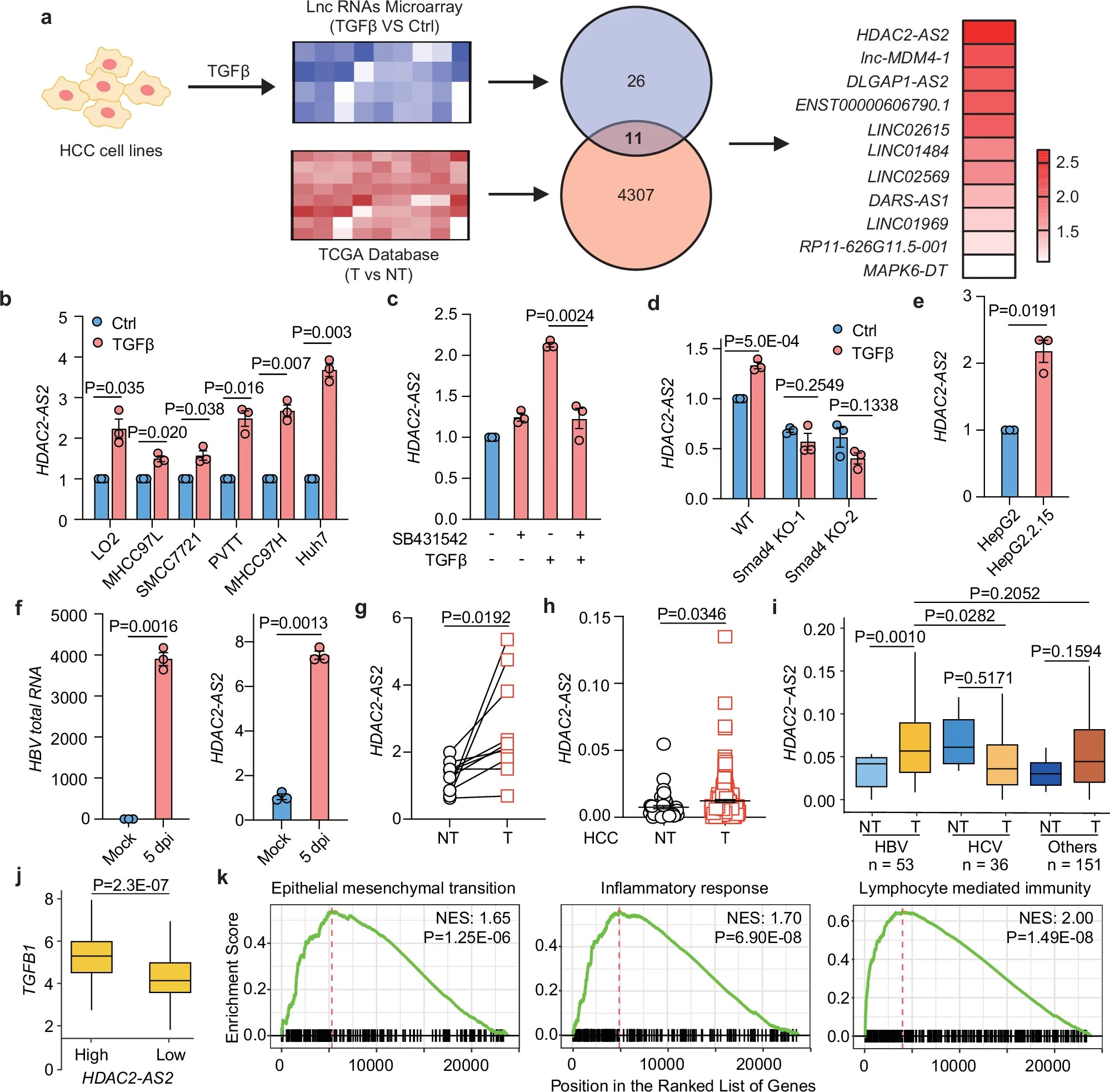
HDAC2-AS2在肝细胞癌免疫逃逸中的作用
研究人员首先通过筛选多种HCC细胞系,发现HDAC2-AS2在TGF-β信号通路激活后表达显著上调。TGF-β是一种在肝癌发生和进展中扮演重要角色的细胞因子,HDAC2-AS2的高表达与HCC患者的不良预后密切相关。值得注意的是,HDAC2-AS2的高表达并不直接影响肿瘤细胞的增殖,研究人员因此推测HDAC2-AS2可能通过其他机制参与肝细胞癌的免疫逃逸。
进一步的实验揭示,HDAC2-AS2通过细胞外囊泡(EVs)被肿瘤细胞分泌到肿瘤微环境中。这些EVs作为“信息传递者”,将HDAC2-AS2送入肿瘤周围的免疫细胞,尤其是CD8+ T细胞。研究表明,HCC患者血液中的EVs所携带的HDAC2-AS2水平显著高于健康人群,这提示HDAC2-AS2有潜力作为肝癌早期诊断的生物标志物。
HDAC2-AS2与免疫逃逸的关系
HDAC2-AS2进入免疫细胞后,会与细胞内的CDK9蛋白结合。CDK9是一种关键的细胞周期蛋白依赖性激酶,对T细胞的激活和功能至关重要。HDAC2-AS2与CDK9结合后,导致CDK9蛋白水平下降,进而抑制CD8+ T细胞的抗肿瘤功能,表现为细胞耗竭和凋亡的增加,抗肿瘤活性显著降低。这个发现揭示了HDAC2-AS2在肝细胞癌免疫逃逸中的关键作用。
HDAC2-AS2与免疫治疗的关联
此外,研究还发现,肝细胞癌中HDAC2-AS2的高表达与免疫检查点抑制剂(如PD-1抗体)治疗的敏感性相关。PD-1是一种免疫检查点蛋白,抑制其活性能够恢复T细胞的抗肿瘤功能。研究显示,HDAC2-AS2可能通过调节CDK9蛋白的作用,间接影响免疫治疗的效果。进一步的单细胞RNA测序技术分析表明,免疫检查点阻断治疗能够增强CD8+ T细胞的功能,这进一步确认了CDK9在肝癌免疫治疗中的重要性。
未来展望
随着研究的深入,科学家们希望能够通过进一步探讨HDAC2-AS2及其相关机制,找到更多有效的免疫治疗策略,为肝癌患者带来更多的生存希望。通过精准治疗,患者有望获得更长的生存期,并提高生活质量。
总的来说,HDAC2-AS2作为一个新的分子靶点,为肝细胞癌的免疫逃逸机制提供了全新的视角,也为未来的精准治疗开辟了新的方向。