突破性进展!阿尔茨海默病治疗新曙光,精准干预或成关键
 搜医药
搜医药
关键词: #健康资讯
 搜医药
搜医药
关键词: #健康资讯
阿尔茨海默病(AD)作为一种常见的神经退行性疾病,一直是医学研究中的难题。回顾其历史,阿尔茨海默病最早的记载可以追溯到1901年,当时德国医生阿洛伊斯·阿尔茨海默接诊了一位出现异常行为的女性患者。她常常答非所问,语言混乱,表现出明显的认知障碍。阿尔茨海默医生详细记录了她的症状,但真正的发现发生在患者去世后。1906年,阿尔茨海默通过解剖她的大脑,发现了大脑萎缩和大量沉积物,类似“老年斑”,这为后续的研究提供了关键线索。
β淀粉样蛋白的发现
1910年,阿尔茨海默医生所描述的这种疾病被命名为阿尔茨海默病。然而,由于当时科技水平的限制,阿尔茨海默病的研究进展相当缓慢。直到1984年,科学家们才发现了患者大脑中异常沉积物的组成——一种叫做β淀粉样蛋白(Aβ)的错误折叠蛋白。Aβ由一种名为淀粉样前体蛋白(APP)的蛋白质通过蛋白酶错误切割产生。这一发现为AD的研究开辟了新的方向。
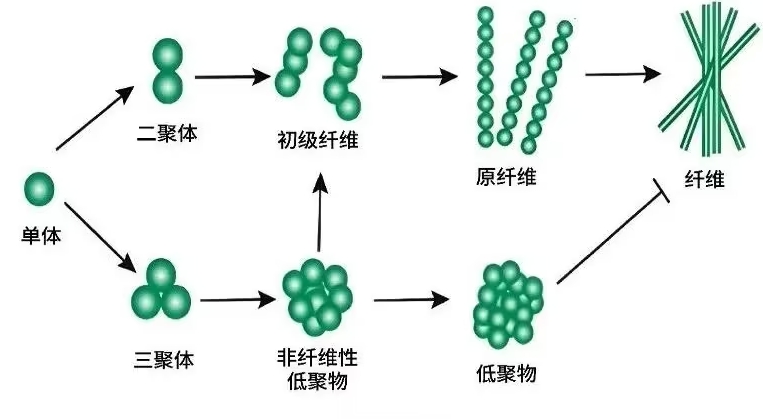
Aβ的聚集与神经毒性
Aβ在AD患者的大脑中不断生成,超出了正常清除能力,逐渐聚集形成寡聚体、原纤维,并最终沉积为不溶性的淀粉样斑块。Aβ不仅直接损害神经细胞,还通过一系列连锁反应,促进tau蛋白的磷酸化,导致神经元缠结,进而加剧神经炎症和氧化损伤等效应,推动疾病进程。
Aβ斑块的作用与研究转向
早期的研究普遍认为Aβ斑块是导致认知功能障碍的主要原因,因此大多数治疗策略聚焦于清除Aβ斑块。然而,随着研究的深入,科学家发现,有些患者尽管大脑中存在大量Aβ斑块,但其认知功能下降的程度并不完全与斑块的数量匹配。这一现象促使研究者重新审视Aβ斑块的作用。
可溶性Aβ寡聚体的关键作用
新的研究发现,Aβ的中间产物——可溶性的Aβ寡聚体,比大块的斑块更具神经毒性。这些可溶性聚集体能够直接损害神经突触,干扰神经元之间的信号传递,导致神经元退化。这一发现让科学家意识到,要有效治疗AD,必须在早期干预时,针对这些最具毒性的Aβ聚集体进行精准治疗。
Aβ靶向治疗的挑战与突破
基于对Aβ级联假说的深入理解,科学家们投入了大量的研究资源以开发针对Aβ的药物。2003年,Aβ疫苗AN1792进入临床试验,曾被寄予厚望,但试验中出现了严重的脑膜脑炎,令其失败。此后,γ-分泌酶抑制剂、BACE抑制剂等药物也未能取得理想效果。科学家们逐渐认识到,单纯减少Aβ斑块并不足以改善症状,而必须精准干预Aβ的错误折叠聚集过程。
仑卡奈单抗:精准治疗的曙光
经过多年的研究,科学家终于找到了突破口——2012年,研究确认可溶性Aβ寡聚体的浓度与认知功能损伤密切相关。这一发现推动了新一代抗Aβ药物的研发。2023年,仑卡奈单抗(Lecanemab)获得批准,这是一种人源化单克隆抗体,能够特异性识别并清除可溶性Aβ寡聚体,并有效阻止其对神经元的毒性。临床应用中,仑卡奈单抗表现出良好的耐受性,并成功控制了淀粉样蛋白相关性影像异常(ARIA)副作用,成为AD治疗的突破性进展。
未来的希望:早期干预与精准治疗
随着AD药物治疗的不断进步,未来的治疗策略将更注重早期筛查和精准干预。通过早期发现和干预,我们可以在症状出现前进行有效治疗,减缓神经元的损伤,延缓疾病的进展。科学家们还在探索其他潜在的治疗靶点,如tau蛋白和神经炎症等,以期开发出更为全面的治疗方案。
此外,新兴技术如人工智能辅助药物筛选和分子影像学技术的应用,也为AD的早期诊断和精准治疗提供了强大的支持。随着对AD病理机制的深入理解,未来的治疗方案将更加个性化和精准,为AD患者带来更好的治疗前景和生活质量。
结语
虽然阿尔茨海默病的治疗之路依旧充满挑战,但随着对Aβ病理机制的深入研究,以及新一代靶向药物的问世,我们正在逐步接近治愈的目标。未来,随着科技进步和治疗手段的不断完善,AD患者有望迎来更加光明的前景。

2025-04-02
2025-04-02

2025-04-02
2025-04-02
2025-04-02